
铂类药物联合三代化疗药是驱动基因阴性患者的标准治疗,联合免疫检查点抑制剂为这部分患者的一线治疗提供了新的治疗策略。PD-1在T淋巴细胞中高表达并负性调节T淋巴细胞激活。针对PD-1免疫检查点抑制剂——纳武利尤单抗、帕博利珠单抗和针对PD-L1的免疫检查点抑制剂——阿替利珠单抗,为驱动基因阴性患者带来了新的一线治疗选择。此外,纳武利尤单抗和帕博利珠单抗也是铂类药物进展后,晚期非小细胞肺癌患者的标准二线治疗选择。
研究发现,贝伐珠单抗可通过阻断VEGF解除抑制性免疫微环境,并促进血管正常化,从而与免疫检查点抑制剂产生协同作用。IMpower150研究发现,卡铂+贝伐珠单抗+紫杉醇基础上,进一步联合阿替利珠单抗,相较于单纯化疗可给患者带来额外获益。在一项Ib临床研究中,纳武利尤单抗联合化疗+贝伐珠单抗具有较好的耐受性。本研究旨在通过确认性III期临床,探索这一联合治疗策略的疗效及安全性。
这是一项随机、双盲、安慰剂对照的III期临床研究,共在日本、韩国、台湾的135家研究中心进行。研究纳入IIIb或IV期组织病理学确认的非鳞、非小细胞肺癌,且既往未经过系统治疗,稳定性脑转移患者允许入组。符合入组标准的患者按照1:1的比例,随机分为纳武利尤单抗或安慰剂联合卡铂+紫杉醇+贝伐珠单抗治疗。研究基于PD-L1表达水平(≥50%,1%~49%及<1%),PS评分(0分vs.1分)及性别进行分层。药物及具体剂量如下:纳武利尤单抗360mg,卡铂AUC=6,紫杉醇200mg/m2,贝伐珠单抗15mg/kg,每三周给药一次,治疗上限6周期,未进展患者接受纳武利尤单抗/安慰剂联合贝伐珠单抗维持治疗,直至疾病进展、出现不可耐受毒性反应或患者撤销知情同意。研究不允许使用免疫抑制药物、等效剂量>10mg/d的地塞米松。同时,纳武利尤单抗及贝伐珠单抗也不允许进行剂量调减。
该研究的主要终点为独立评审委员会评估的PFS,次要研究终点为OS、ORR、DOR及安全性。前48周每6周进行一次疗效评估,随后每12周进行一次疗效评估。
共计550例患者随机化,联合纳武利尤单抗和不联合纳武利尤单抗均入组275例患者,两组患者基线特点均衡可比。两组均有43.6%的患者PD-L1<1%。首次数据分析时,两组分别有27.1%和16.0%的患者继续接受原方案治疗。中位治疗持续时间分别为8.2个月和6.9个月。疾病进展后,两组分别有44.7%和65.1%的患者接受后续治疗,其中,接受免疫检查点抑制剂治疗的患者,占比分别为6.2%和38.5%,全组最小及中位随访时间分别为7.4个月和13.7个月。两组中位PFS分别为12.1个月和8.1个月,HR=0.56,12个月PFS率分别为50.1%和30.2%(图1)。

图1 两组PFS数据
亚组分析显示,不同PD-L1表达水平的患者均可以从这一联合治疗中获益(图2)。

图2 亚组分析
其中,PD-L1表达≥50%的患者,两组中位PFS分别为9.9个月和6.9个月,HR=0.55;PD-L1表达1%~49%的患者,两组中位PFS分别为11.0个月8.4个月,HR=0.63,PD-L1表达<1%的患者,两组中位PFS分别为13.6个月和8.4个月,HR=0.55(图3)。
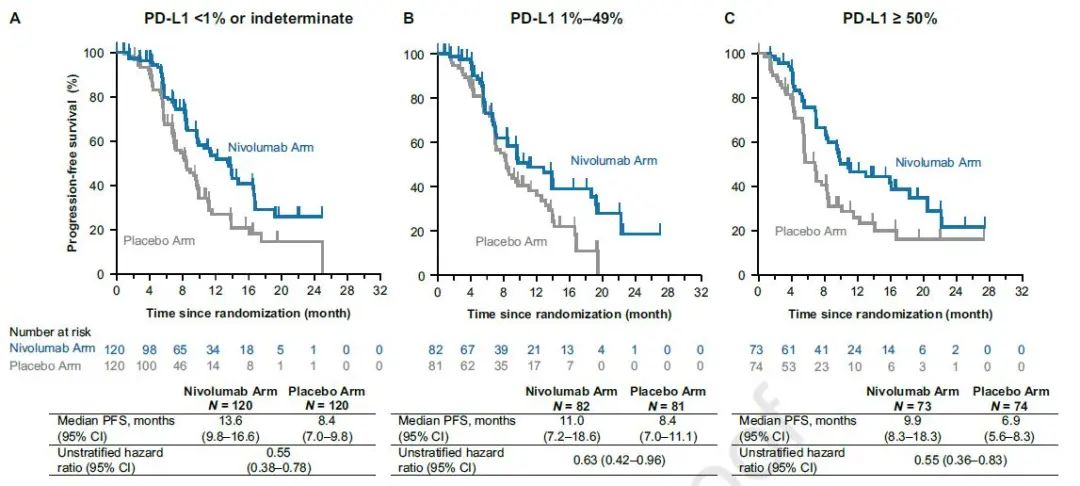
图3 PFS的亚组分析
数据分析时,两组分别有29.8%和33.8%的患者出现OS事件,两组中位OS均不成熟,HR=0.85(图4)。
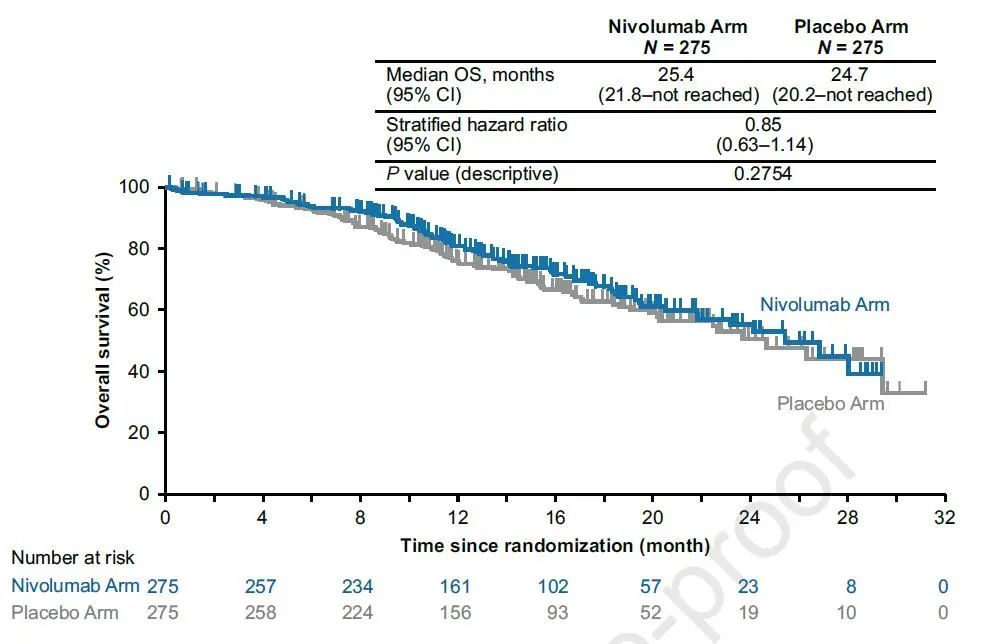
图4 患者的OS数据
独立评审委员会评估的ORR分别为61.5%和50.5%,中位响应持续时间分别为11.0个月和7.0个月。
安全性:两组分别有98.5%和99.6%的患者出现治疗相关不良反应,其中,3度及以上不良反应发生率分别为73.6%和72%,严重不良反应发生率分别为41.8%和26.9%,两组分别有16.5%和4.4%的患者因治疗相关的不良反应导致治疗永久终止(图5)。

图5 两组的安全性数据
这项研究发现,对于初治非鳞、非小细胞肺癌患者,在标准紫杉醇+卡铂+贝伐珠单抗的基础上,联合纳武利尤单抗可以给患者带来获益,可考虑成为新的治疗选择。
以免疫检查点抑制剂为基础的联合治疗革新了驱动基因阴性的晚期NSCLC患者的一线治疗。其中,与化疗联合是主流方向,在这些研究中,以PD-1和PD-L1为基础的联合所展现的效果及前景也不尽相同,由于两种药物之间目前并无直接的对头比较,将来大概率也不会有正面交锋,因此,通过既往研究数据的间接比较可能提供重要线索,本文将对相关内容进行简单总结。
目前,免疫检查点抑制剂联合化疗一线治疗非鳞癌(主要指腺癌)的患者有5项重要研究:KeyNote-189研究(帕博利珠单抗)、CameL研究(卡瑞丽珠单抗)、ORIENT-11(信迪利单抗)、RATIONALE 304(替雷利珠单抗)和IMpower-132研究(阿替利珠单抗),其中,除了阿替利珠单抗单抗(针对PD-L1)外,其余几款药物均为针对PD-1的免疫检查点抑制剂。

从数据上看,虽然联合PD-L1的PFS与联合PD-1相似,但这种获益似乎并未转化为OS的获益。
目前,免疫检查点抑制剂联合化疗一线治疗鳞癌的患者有5项重要研究:KeyNote-407研究(帕博利珠单抗)、IMpower-131研究(阿替利珠单抗)、CameL-sq研究(卡瑞丽珠单抗)、ORIENT-12(信迪利单抗)和RATIONALE 307(替雷利珠单抗),在鳞癌中的研究显示了与腺癌相似的结果。
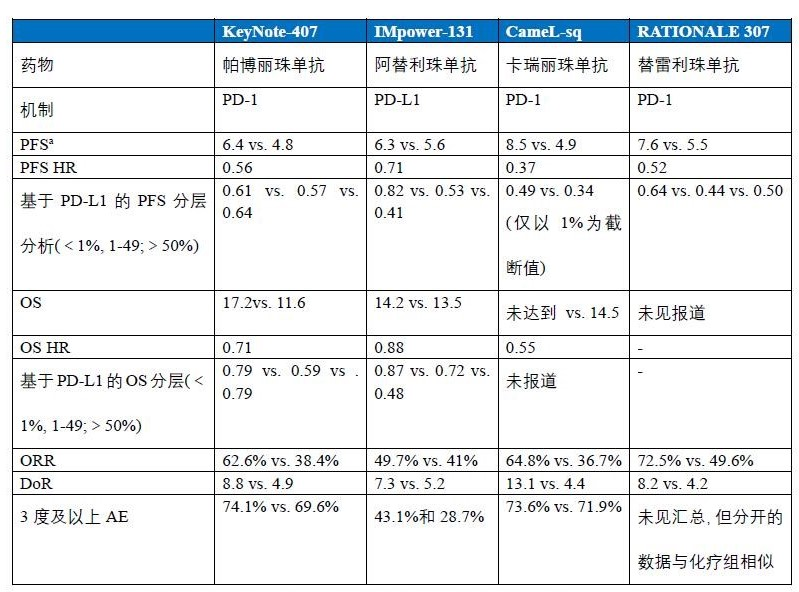
从上面的数据可以直观的发现,联合PD-1的研究,其PFS的HR值均在0.5左右,且提高的幅度较联合PD-L1更优,更重要的是,联合PD-1基本都是PFS和OS的双重获益,而联合针对PD-L1的治疗则OS并无获益。
由于头对头比较可能需要较大的样本含量、较长的研究周期,因此,这两类药物之间并无直接的头对头比较,但基于Meta分析的间接比较则有相关报道。今年3月份发表于Lung Cancer的一项研究比较了化疗联合Pembrolizumab或Atezolizumab的间接比较数据,结果发现,两组中位PFS分别为9.3个月和7.3个月,HR=0.79,两年PFS率分别为26.3%和18.5%,中位OS分别为23.0个月和18.2个月,HR=0.80,两年OS率分别为48.2%和40%,均在联合Pembrolizumab组显示了更好的疗效。
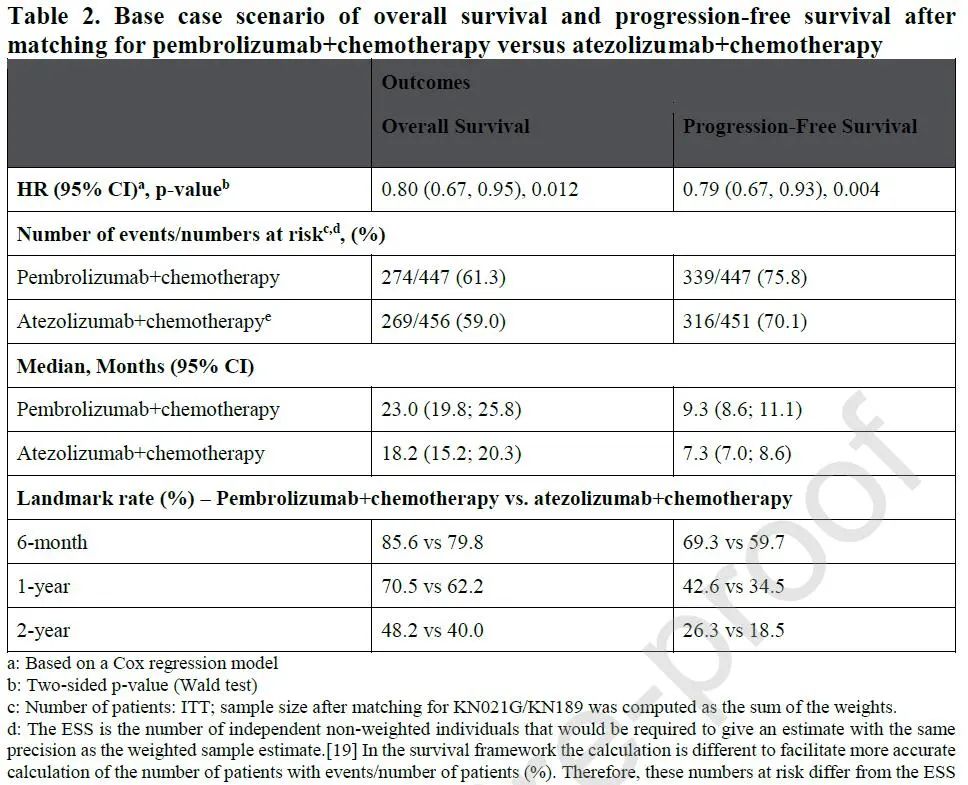
从现有的数据来看,在NSCLC患者的一线联合化疗中,与PD-1联合的数据比联合PD-L1更优,尤其是多数研究获得了PFS和OS的双阳性结果,但是,联合PD-L1似乎显示了更优的安全性,尤其是3度及以上不良反应的发生率更低。而对于临床应用,可能仍需要结合实际情况做进一步的探索。





 京公网安备 11010502033352号
京公网安备 11010502033352号