导读:对于早期乳腺癌,目前全球面临着两大亟待解决的问题:1、如何安全地豁免化疗?2、哪类患者能真正最大程度地从化疗、靶向或内分泌治疗中获益?如何在争取治愈的前提下采用低毒的治疗方案提高生活质量是一个非常值得探索的方向,所谓“加法容易减法难”。在患者治疗过程中我们当然想能用靶向治疗或内分泌治疗时尽量不用化疗;能用紫杉解决尽量舍弃蒽环……这也是MINDACT、WSG PlanB、RxPonder、NNBC-3、TAILORX、WSG TPII等研究的最新结果备受瞩目的缘由。
西德研究组(WSG)巧妙地运用新辅助治疗平台,紧紧围绕人表皮生长因子受体2(HER2)、激素受体(HR)两个可靠靶点开展的伞型系列ADAPT研究,目的就是探索出所有分子分型中可以精准降阶梯的亚人群,最近几年陆续公布的结果,也将成为未来临床试验设计的重要参考依据。

ADAPT,adjuvant dynamic marker-adjusted personalized therapy trial optimizing risk assessment and therapy response prediction in early breast cancer(辅助动态标记物调整个体化疗法优化早期乳腺癌风险评定和治疗缓解预测)的缩写,包括的注册研究有:ADAPT Umbrella:NCT01781338;ADAPT HR+/HER2-:NCT01779206;ADAPT HER2+/HR+:NCT01745965;ADAPT HER2+/HR-:NCT01817452;ADAPT TN:NCT01815242(图1)。
笔者尝试用最通俗的语言凝练此研究:“一、二、三、四”,即新辅助平台撑起一把大伞;两次穿刺活检;三个时点生物标记物的动态比较;四种分子分型分类而治。具体来说,只要穿刺病理证实为单侧乳腺原发浸润性癌就可以入组,这也是它为何被称之为伞型研究的原因。所以该研究可以涵盖所有分子分型的早期乳腺癌患者,根据分子分型首先制定不同的三周期低毒药敏新辅助方案,采集三周期新辅助治疗方案前后两次的肿物穿刺标本,再按计划将制定方案完成后接受手术,比较病理完全缓解率(pCR)、早期缓解者与未缓解者pCR率,更值得关注的是早期缓解者的动态生物标记物的鉴定结果。【1】
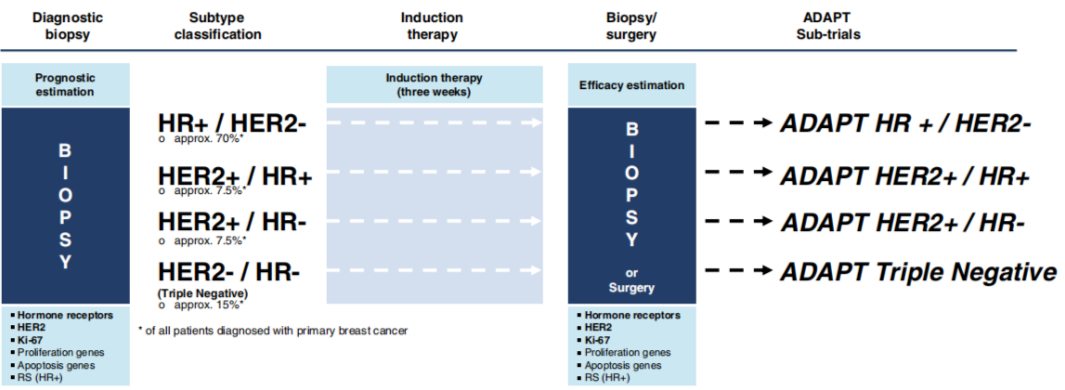 图1:ADAPT伞型研究
图1:ADAPT伞型研究
这是一组激素受体阳性的亚群,如何早期甄别出哪些可以豁免化疗,哪些又可从化疗中获益的精准人群是其最终目的。研究者采用三周期诱导性新辅助内分泌治疗,借助OncotypeDX的RS评分系统和两次Ki67的变化以及三周期后Ki67百分比是否小于10%来帮助制定下一步的治疗决策。2020年ASCO大会上公布了在此基础上设计的ADAPT cycle研究【2】。这项临床试验入组了2000多例患者,对患者进行细致分层,包括RS评分、ki67、组织学分级和后期进行内分泌诱导之后ki67的变化,最后将有中度复发风险的患者甄别出分成两组,一组继续进行内分泌治疗,另一组行4-6个月化疗,手术后比较pCR率(图2)。我们可以看到通过这样的设计,即便初始状态肿瘤大于3cm甚至腋结阳性、RS评分超过12分、组织学分级3级、Ki67≥20%,只要对内分泌治疗敏感都有豁免化疗的可能性。
 图2:ADAPT cycle研究设计
图2:ADAPT cycle研究设计
目前正在召开的2020ESMO大会上,WSG研究组公布了WSG-ADAPT HR+/HER2-转化医学数据的分析结果(ESMO Virtual Congress 2020-164MO,图3)。“Luminal型乳腺癌新辅助内分泌治疗中Ki67反应迟缓与导致内分泌耐药的基因突变相关”。【3】该试验通过二代测序(NGS)或数字化PCR(dPCR)检测了接受新辅助内分泌治疗的622名早期乳腺癌患者的生物样本中内分泌治疗抵抗基因(ARID1A、CCND1、ERBB2、ESR1、FGFR1、PAK1和TP53)的突变情况。从结果看出,56.4%(351/622)患者至少存在一种以上内分泌耐药基因的突变;在某些患者中还可以观察到CCND1、FGFR1、PAK1拷贝数的变化。非常重要的发现是,TP53的突变与新辅助内分泌治疗的不完全生长抑制具有显著相关性(P<0.0001)。该项研究结果提示:与内分泌耐药和HR+转移性乳腺癌相关的基因表达突变在早期乳腺癌阶段就已存在,且与短期的诱导性新辅助内分泌治疗Ki67降低幅度不明显密切相关。因此,用Ki67作为新辅助内分泌治疗的反应指标是切实可行的,并且可以甄别出遗传性内分泌治疗抵抗的亚群,行化疗干预【4】。

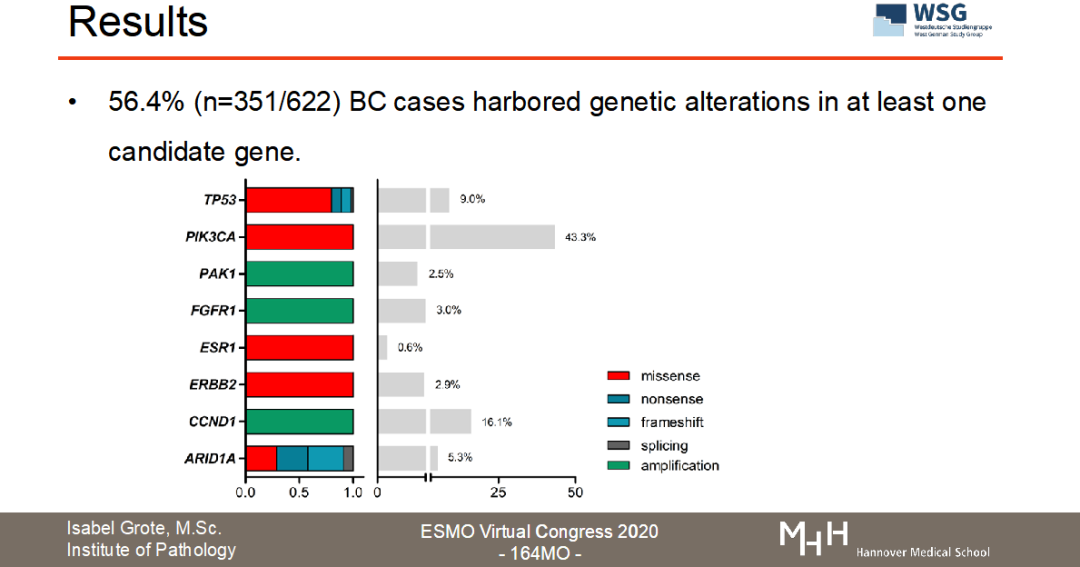
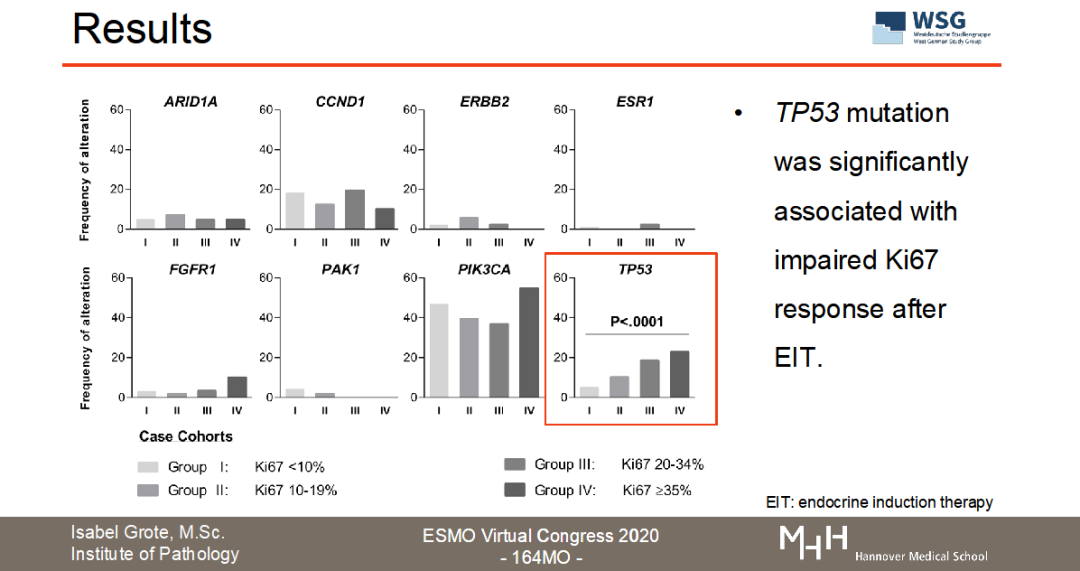
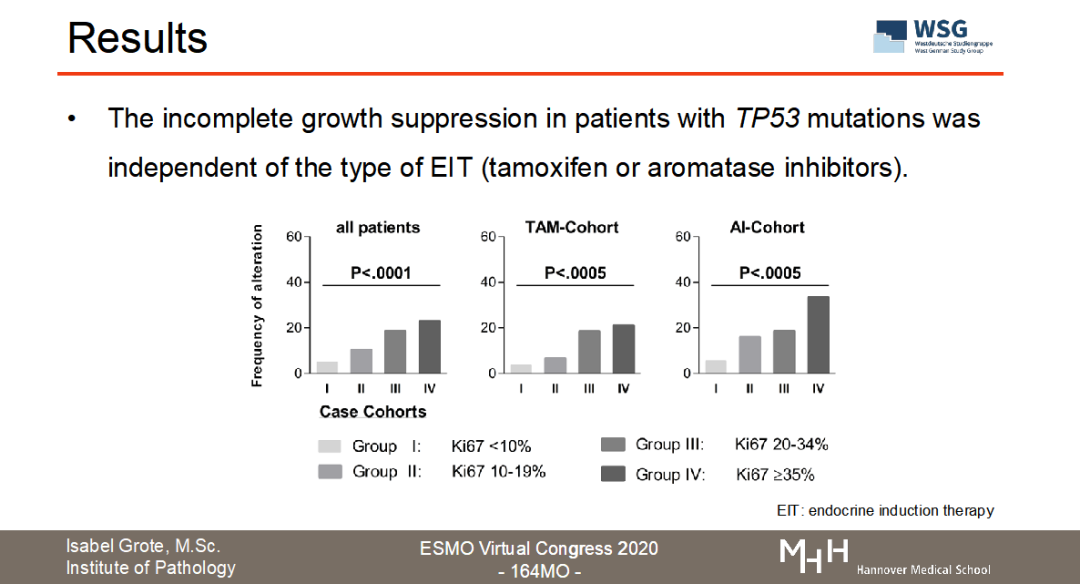
图3:WSG-ADAPT HR+/HER2-转化医学数据的分析结果
对于三阳性乳腺癌患者,能否通过同时有效抑制ER和HER2双通路从而找到可以豁免化疗的人群呢?该研究对其进行了探索,并将纳入患者分为三组:第一组T-DM1单药治疗;第二组T-DM1联合内分泌治疗;第三组曲妥珠单抗联合内分泌治疗,观察早期疗效(图4)。2017年发布的结果显示,在HR+/HER2+患者中应用T-DM1单药pCR可达到41%,尽管T-DM1联合内分泌治疗组总体pCR与单用T-DM1组相差无几(41.5%),但早期缓解者pCR率明显高于早期未缓解者(35.7% vs 19.8%),提示的确存在一部分三阳性者可以避免传统细胞毒性药物的副作用取得较好的疗效。此外,研究者还发现给予T-DM1后,患者基质肿瘤浸润淋巴细胞(sTILs)水平升高,说明T-DM1可诱导肿瘤免疫微环境改变,这样的转化研究结果期待成为T-DM1未来研究设计的重要启示。【5】
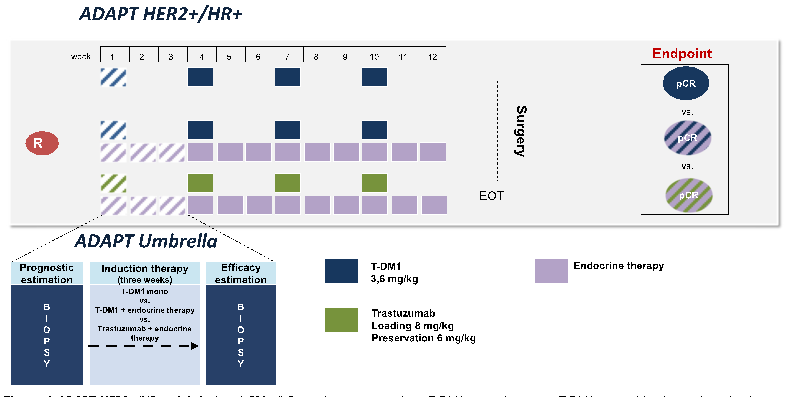
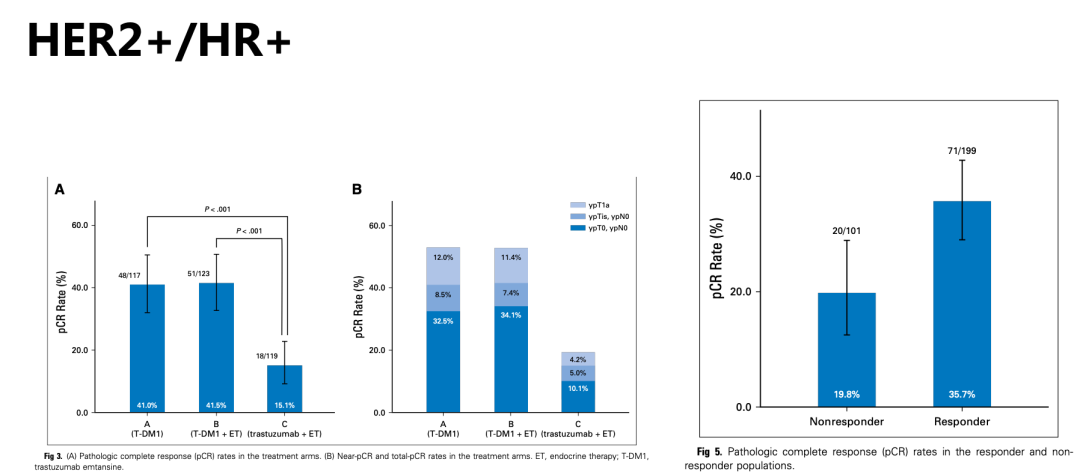
图4:ADAPT HR+/HER2+研究设计及结果
此项研究中,将HR-,HER2+者分成两组,一组接受12周的妥妥双靶治疗(H+P),另外一组是在妥妥双靶的基础上联合化疗(紫杉醇单药)进行三周的诱导后行穿刺活检,再将剩余的治疗完成(图5),目的是为甄别出单纯双靶而不化疗即可获益的亚组人群。研究结果显示双靶治疗联合紫杉醇组pCR率达到了90.5%,远高于双靶治疗组。而更为引起关注的是研究组对早期缓解的定义。为第三周进行穿刺活检时Ki67指数较基线降低超过30%或低细胞密度(low celluarity,计数浸润性肿瘤细胞<500个)。我们知道除了pCR,能否将可以达到pCR的患者提早预测出来同样重要,此项研究的另一个重要结果显示:早期缓解者更容易达到pCR。双靶治疗联合紫杉醇组中,42名早期缓解者中40名达到了pCR,最终的pCR率为95%。【6】
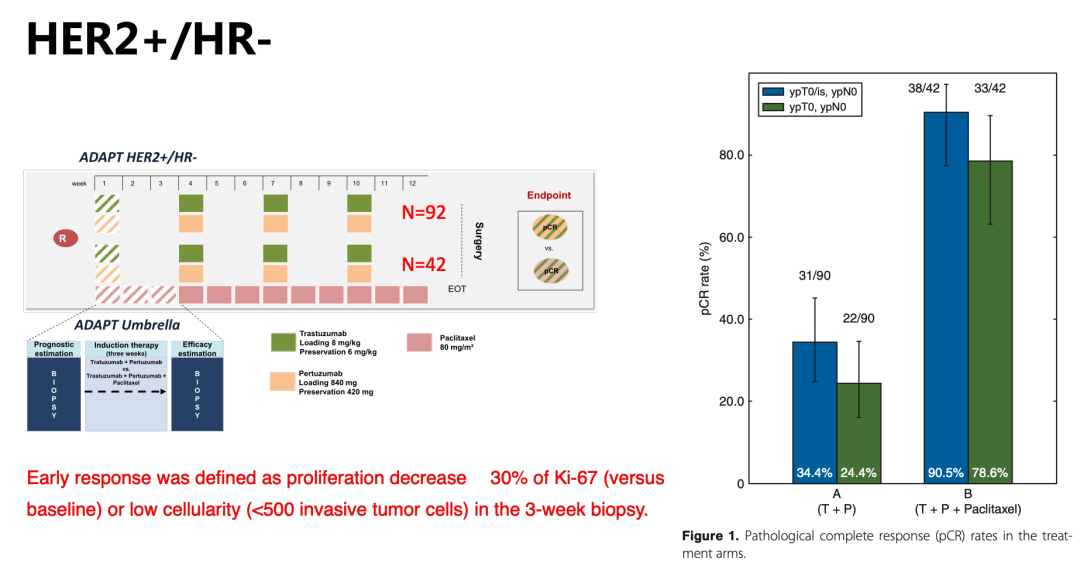

图5:ADAPT HR-/HER2+研究设计及结果
即TNBC组(图6),共纳入336例cT1c-4cN0/+者,一组为白蛋白结合型紫杉醇+吉西他滨,另外一组为白蛋白结合型紫杉醇+卡铂,四周期后手术。两组pCR率分别为28.7%和45.9%。一个有趣的结果是达到pCR者后续补充4周期蒽环联合环磷酰胺并无更多的总生存获益。另外,所有入组患者均接受了PAM50二代测序,根据测序结果将其进行亚分类(Normal、Basal、Luminal-A和HER2-enriced),观察这些亚分类中的PCR率有无差异【7】。结果显示白蛋白结合型紫杉醇联合卡铂在Basal和HER2-enriched两个亚组中显示出更好的pCR率。亚组分析提示Ki67高表达及绝经前的患者似乎更能从卡铂联合白蛋白结合型紫杉醇中获益,即更容易达到pCR。2019年的ASCO的会议上公布了这些患者远期生存。和非pCR相比,得到pCR的这些患者的远期的复发风险也相对低。后续的生物标记物相关的转化结果将为TNBC如何在辅助化疗阶段降阶梯给出重要的提示和线索。【8】
此外,2020年7月该研究组还公布了基于ADAPT系列研究中有关疗效评价的亚课题研究成果。比较了彩超与核磁共振在预测pCR和残余病灶的准确性于不同分子分型的不同。研究得出重要结论:不同分子分型、不同大小甚至接受不同方案新辅助治疗者应该选择的影像学评估工具是不同的,如何量体裁衣、因材施教,以期达到最精准的治疗决策指导,最佳的影像学评估方法值得深思【9】。见推送号https://mp.weixin.qq.com/s/ovH-eGUGNi9I0aY-18m2Ig
总而言之,由于新辅助治疗理念的快速发展和新药的冲击,今天我们认为经典的手术方式和辅助治疗方案也在不停地接受挑战,类似I-SPYⅡ、WSG ADAPT等新一代临床研究设计令人耳目一新。笔者看来,这些研究的主要终点pCR固然重要,但早期得到缓解者与未缓解者的动态变化生物标记物的探索似乎对未来转化医学与临床研究方向的把握与选择至关重要。
多年来,西德研究小组(WSG)的领军人物Nadia Harbeck教授一直在从事着这方面的科研工作,也因此获得了2020ESMO大会的终身成就奖。她和WSG同事们在乳腺癌领域默默奉献、坚持创新,将真正有远见的试验想法转化为可能改变实践的结果,为乳腺癌患者带来了更多希望。


1、Hofmann D , Nitz U , Gluz O , et al. WSG ADAPT – adjuvant dynamic marker-adjusted personalized therapy trial optimizing risk assessment and therapy response prediction in early breast cancer: study protocol for a prospective, multi-center, controlled, non-blinded, randomized, investigator initiated phase II/III trial[J]. Current Controlled Trials in Cardiovascular Medicine, 2013, 14.2、Harbeck N, Gluz O, Christgen M, et al. ADAPTcycle: Adjuvant dynamic marker-adjusted personalized therapy comparing endocrine therapy plus ribociclib versus chemotherapy in intermediate-risk HR+/HER2-early breast cancer[J]. 2019.3、Grote I, Bartels S, Kandt L, et al. Impaired Ki67 response towards neoadjuvant endocrine therapy in luminal breast cancer is associated with mutations conferring endocrine resistance: WSG-ADAPT HR+/HER2-translational results[J]. Annals of Oncology, 2020, 31: S306.4、Nitz U A, Gluz O, Christgen M, et al. De-escalation strategies in HER2-positive early breast cancer (EBC): final analysis of the WSG-ADAPT HER2+/HR− phase II trial: efficacy, safety, and predictive markers for 12 weeks of neoadjuvant dual blockade with trastuzumab and pertuzumab±weekly paclitaxel[J]. Annals of Oncology, 2017, 28(11): 2768-2772.5、Harbeck N, Gluz O, Christgen M, et al. De-escalation strategies in human epidermal growth factor receptor 2 (HER2)–positive early breast cancer (BC): final analysis of the west german study group adjuvant dynamic marker-adjusted personalized therapy trial optimizing risk assessment and therapy response prediction in early BC HER2-and hormone receptor–positive phase II randomized trial—efficacy, safety, and predictive markers for 12 weeks of neoadjuvant trastuzumab emtansine with or without endocrine therapy (ET) versus trastuzumab Plus ET[J]. Journal of Clinical Oncology, 2017, 35(26): 3046-3054.6、Nitz U A, Gluz O, Christgen M, et al. De-escalation strategies in HER2-positive early breast cancer (EBC): final analysis of the WSG-ADAPT HER2+/HR− phase II trial: efficacy, safety, and predictive markers for 12 weeks of neoadjuvant dual blockade with trastuzumab and pertuzumab±weekly paclitaxel[J]. Annals of Oncology, 2017, 28(11): 2768-2772.7、Gluz O, Kolberg‐Liedtke C, Prat A, et al. Efficacy of deescalated chemotherapy according to PAM50 subtypes, immune and proliferation genes in triple‐negative early breast cancer: Primary translational analysis of the WSG‐ADAPT‐TN trial[J]. International journal of cancer, 2020, 146(1): 262-271.8、Gluz O, Nitz U, Liedtke C, et al. Comparison of neoadjuvant nab-paclitaxel+ carboplatin vs nab-paclitaxel+ gemcitabine in triple-negative breast cancer: randomized WSG-ADAPT-TN trial results[J]. JNCI: Journal of the National Cancer Institute, 2018, 110(6): 628-637.9、Graeser M, Schrading S, Gluz O, et al. Magnetic resonance imaging and ultrasound for prediction of residual tumor size in early breast cancer within the ADAPT subtrials[J]. 2020.
医学博士/博士后,副主任医师,副教授,硕士生导师
大连医科大学附属第二医院乳腺疾病研究中心副主任
中华医学会肿瘤学分会乳腺学组青委会委员
中国妇幼保健协会青委会委员
中国医药教育协会乳腺病专业委员会乳腺癌多学科诊疗学组委员
中国康复医学会修复重建外科专业委员会美容外科分会委员
JCO中文版青年编委
全球卫生部后备人才库
辽宁省细胞生物学学会乳腺肿瘤精准治疗与临床科研专业委员会副主任委员
辽宁省生命科学学会乳腺疾病微创诊断及治疗专业委员会青委会副主任委员





 京公网安备 11010502033352号
京公网安备 11010502033352号