2020年诺贝尔化学奖授予Jennifer Doudna和Emmanuelle Charpentier两位科学家,以表彰她们发明CRISPR-Cas9的基因修饰方法。CRISPR-Cas9已广泛应用于操纵细胞培养和动植物基因编辑,包括肿瘤的研究和治疗;而这项基因“魔剪”技术与乳腺癌之间也有着许多“不解之缘”。
 Emmanuelle Charpentier(左)和Jennifer Doudna(右)
Emmanuelle Charpentier(左)和Jennifer Doudna(右)
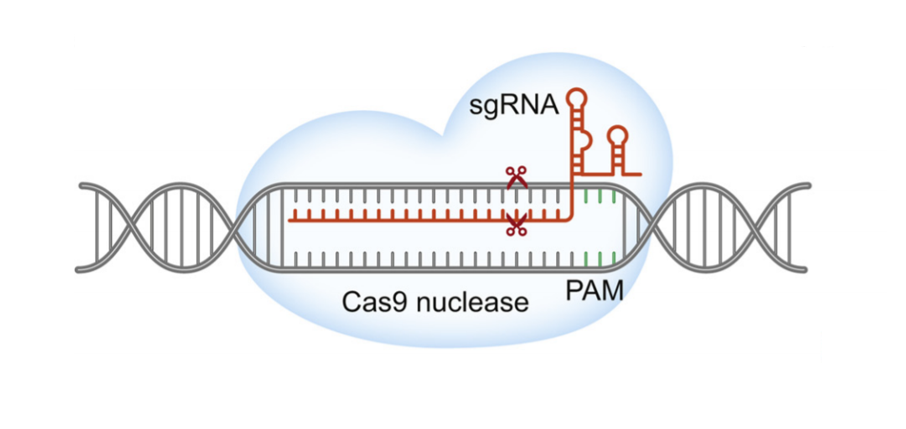
CRISPR-Cas9是继锌指核酸内切酶(ZFN)和类转录激活因子效应核酸酶(TALEN)之后出现的第3代基因编辑技术,主要由Cas9蛋白和单链前导RNA(sgRNA)所组成,其中Cas9蛋白起到切割DNA双链的作用,sgRNA起引导的作用,在sgRNA的引导下通过碱基互补配对原则,Cas9蛋白可对不同的靶部位进行切割,实现DNA的双链断裂。
诺贝尔奖颁给了两位女性科学家,是因为她们首次在体外证明使用Cas9的CRISPR系统可以切割任意DNA链。但在CRISPR-Cas9“魔剪”技术的背后,人们没有忘记其他科学家的一些开创性工作,比如为基因编码技术奠定基础的“同源重组”研究。
上世纪90年代,另一位女科学家Maria Jasin发现BRAC1/2突变和遗传性乳腺癌具有很强的相关性,BRCA基因参与DNA同源重组介导的DNA修复,加深了人们对DNA修复机制的理解。今天,利用“合成致死”原理的PARP抑制剂已经广泛应用于携带BRCA突变的乳腺癌治疗。
Jasin在研究同源重组的过程中,使用了一种限制性核酸内切酶(I-SceI)来达到DNA断裂,并发现细胞基因组发生了改变。她的工作表明,基因组中的DNA双链断裂可以应用染色体外模板,通过同源重组来修复,这为当前的CRISPR-Cas9等基因组编辑方法奠定了基础。
CRISPR/Cas9具有操作简单、特异性强、效率高等优势,可以利用其对细胞的基因组进行编辑,从而探究肿瘤发生、发展和转移的机理。此外,还可以对引发肿瘤的基因突变进行修复,或对特定蛋白分子进行敲除,从而实现肿瘤的治疗。
构建动物模型——传统的肿瘤动物模型构建是利用同源重组技术对胚胎干细胞(ES)进行基因编辑,获得敲除动物的时间长,饲养成本高。CRISPR/Cas9不需要建立复杂的ES细胞系,大大简化了动物模型的建立。基因编辑先锋科学家张峰已经通过CRISPR/Cas9建立了小鼠肝癌、肺癌模型。
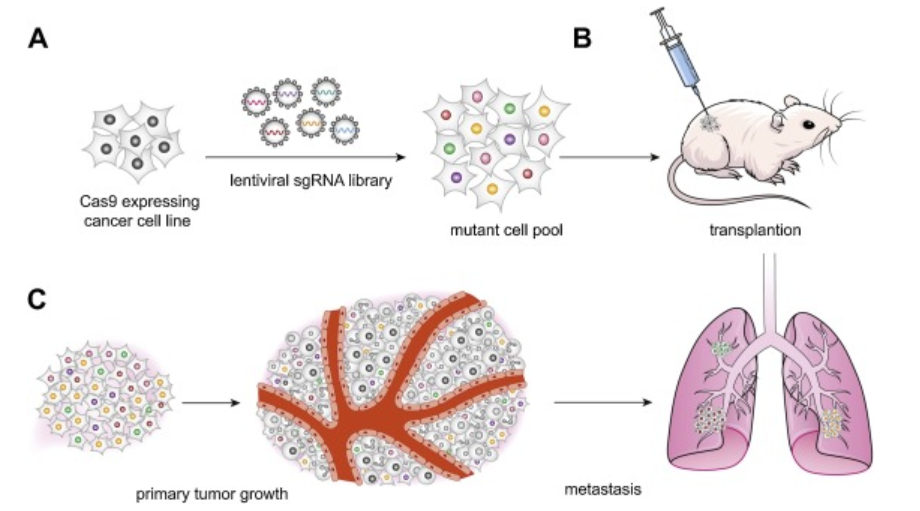
肿瘤机制研究——离体细胞培养是研究肿瘤发病机制所不可缺少的。CRISPR/Cas9可以更方便快捷地获得肿瘤细胞系。此外,CRISPR/Cas9还可以进行规模化的基因筛选、修饰,从而发现有价值的致病基因、耐药基因或治疗靶点。
基因修复和敲除——原癌基因的激活与抑癌基因的沉默均可以导致肿瘤的发生。CRISPR/Cas9敲除原癌基因或修复抑癌基因提供了一种新的肿瘤治疗思路;此外,CRISPR/Cas9还可以对肿瘤患者的T细胞进行基因修饰,从而打破机体的免疫耐受,提高CAR-T制备率和功能,以及增强对免疫检查点抑制剂的免疫原性等。
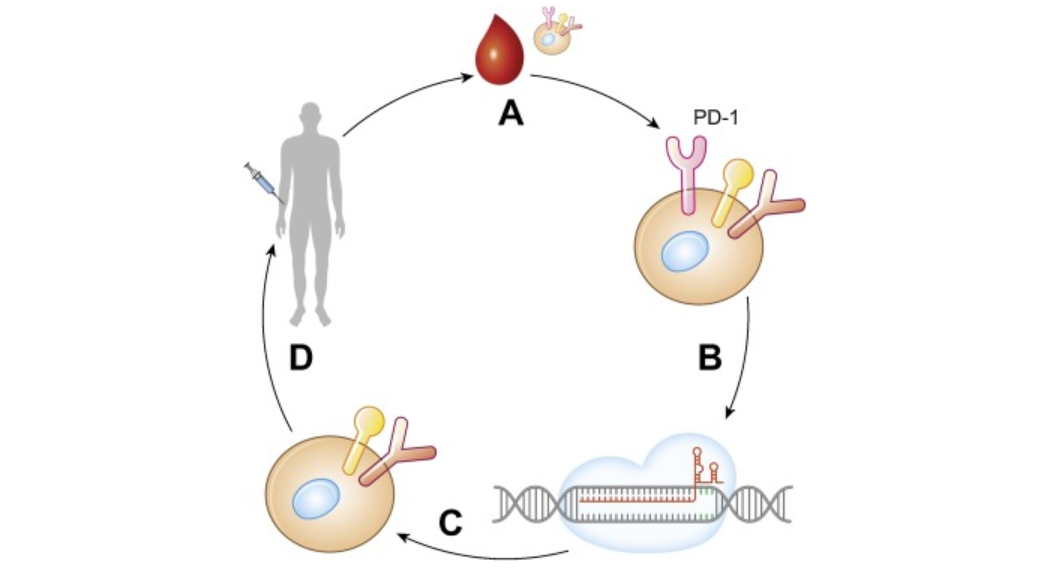
2016年,四川大学华西医院的卢铀教授团队开展了全球第一例应用CRISPR/Cas9技术的治疗肺癌的人体临床试验。在这项非随机、开放标记的Ⅰ期研究(NCT02793856)中,研究人员收集实体瘤患者的外周血淋巴细胞,在T细胞中进行CRISPR/cas9介导的免疫检查点基因PD-1的敲除,并在体外扩增,然后输回病人体内,从而诱导对肿瘤细胞的免疫反应。
科学家在研究乳腺癌的过程中发现了“同源重组”,为后来的基因编码技术奠定了重要基础。今天,CRISPR/Cas9在乳腺癌领域也同样有很多应用,大致上与前述应用无出其右。此处以3个例子来简单了解一下。
乳腺癌模型的建立——浸润性小叶癌(ILCs)在乳腺癌中相对少见,占8-14%,其特征是非粘连的上皮细胞以单列形式侵犯邻近组织,并伴有大量的成纤维细胞和胶原沉积。大多数人类ILCs都会丢失细胞粘附蛋白E-cadherin。利用CRISPR/Cas9在小鼠局部注射Cre重组酶,可诱导E-cadherin失活和AKT-E17K激活,从而形成典型的侵袭性小叶癌症。
乳腺癌治疗靶点——HER2外显子是乳腺癌的驱动因素之一,在乳腺癌细胞中有多个拷贝。HER2外显子12的框移突变可导致HER2显性阴性突变表型,这种改变可抑制HER2下游信号的MAPK/ERK轴和癌细胞增殖。CRISPR/Cas9不完全靶向致癌基因的显性阴性突变体可能是一个潜在的治疗靶点。
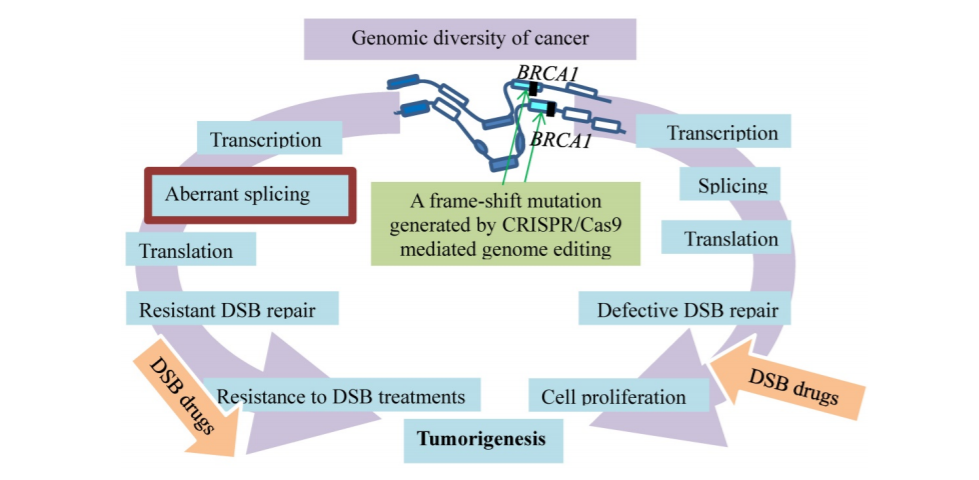
乳腺癌耐药基因——PARP抑制剂已经临床应用于BRCA突变乳腺癌的治疗。一些患者虽然最初表现出改善,但最终会发生药物抵抗和疾病进展。CRISPR/Cas9技术表明,BRCA1基因的种系突变被体细胞选择性剪接绕过,从而导致对抗癌治疗的耐药性。
在乳腺癌的研究过程中,利用“同源重组”原理已经开发了PARP抑制剂等新型靶向药物;与此同时,“同源重组”还为基因编码技术提供了理论基础。目前,CRISPR/Cas9技术已经在乳腺癌以及其他肿瘤领域都展现了巨大的应用潜力。然而,我们需要清楚地认识到,这项技术还存在很多尚未解决的问题,比如脱靶效应,应用于人体时的伦理问题、安全性问题等。希望在科学家的不懈努力下,CRISPR/Cas9能够早日助力人类攻克癌症。
[1]Zhan T, Rindtorff N, Betge J, Ebert MP, Boutros M. CRISPR/Cas9 for cancer research and therapy. Semin Cancer Biol. 2019;55:106-119. doi:10.1016/j.semcancer.2018.04.001[2]Yang H, Jaeger M, Walker A, Wei D, Leiker K, Weitao T. Break Breast Cancer Addiction by CRISPR/Cas9 Genome Editing. J Cancer. 2018;9(2):219-231. Published 2018 Jan 1. doi:10.7150/jca.22554[3]D. Cyranoski. CRISPR gene-editing tested in a person for the first time. Nature, 539 (2016), p. 479, 10.1038/nature.2016.20988





 京公网安备 11010502033352号
京公网安备 11010502033352号