患者,男,68岁,因食欲不振半年余,进食哽噎20余天,呕血2天于2015-08-26入院。
既往史:既往有腰椎间盘突出、椎管狭窄病史,近3年间断服用NSAIDs止痛药物。
血常规:白细胞5×109/L,中性粒细胞百分比55.1%,血小板251×109/L,血红蛋白86g/L,平均红细胞体积80.1fL,平均血红蛋白浓度301g/L。
血生化:钾4.2mmol/L,谷丙转氨酶10.7U/L,谷草转氨酶15.3U/L,白蛋白29.2g/L,总胆红素9.1umol/L,碱性磷酸酶61.6U/L,血清铁3.1umol/L,总铁结合力84.2umol/L。
凝血常规未见异常、肿瘤标志物未见异常升高。
电子胃镜:贲门胃底癌(肿块型),慢性胃炎。病理示:腺癌。
 △ 2015.08电子胃镜
△ 2015.08电子胃镜
胸部CT回报:右肺间质性病变、双肺气肿、右上肺结节影、主动脉硬化、右侧胸膜钙化。
全腹强化CT回报:贲门胃底肿瘤、腹腔淋巴结肿大、动脉硬化。
入院诊断:胃腺癌,cT4N3M0
?
MDT-1讨论
考虑患者贲门胃底癌,伴有呕血、进食哽噎,予以抑酸、补铁、输血、营养支持等对症支持治疗请相关科室会诊,患者出血难以控制,除外绝对手术禁忌。决定行开腹探查术,以解决出血及梗阻等合并症问题。
治疗及评估
手术:于2015-09-02全麻下行近端胃次全切除、食管胃吻合+淋巴结清扫+幽门成形术。
术中见肿物位于位于贲门胃底,约5×4cm,侵出胃壁浆膜层,腹腔内小弯侧及部分小肠系膜可触及肿大淋巴结。
术后病理:胃底溃疡型中-低分化腺癌,侵出浆膜层,累犯神经束;上下切(-),淋巴结6/15;HER2(3+)
病理诊断:胃癌 pT4bN2Mx(IIIB);HER2(3+)
术后恢复:术后腹部CT提示:吻合口区可见引流管影,其内可见造影剂影。考虑吻合口瘘,予以禁食,保持引流管通畅,予以抗炎、抑酸护胃、营养支持等对症处理。症状好转,进食恢复后好转出院。
MDT-2讨论
患者2015-11-23再次入院,病理分期较晚,首次手术因出血等合并症行近端胃切除手术,手术范围达不到根治手术标准,不除外存在肿瘤残留;考虑患者为HER2(3+);建议予SOX化疗联合曲妥珠单抗靶向治疗。
2015-11-23至2016-03-12入院化疗6周期。
具体方案:曲妥珠单抗(首次8mg/Kg,后续6mg/Kg),奥沙利铂 130mg/m2,替吉奥60mg po bid,21天方案。
2016年3月至2016年11月单药赫赛汀靶向治疗8周期。
具体方案:曲妥珠单抗(6mg/Kg,21天方案)。
2016年12月至2019年6月定期复查,未见明显肿瘤复发迹象。
2019-07-22因“胃癌术后3年余,进食呕吐伴上腹痛2月余”再次入院。
胃镜检查:食管下段散在糜烂,胃食管吻合口水肿,稍狭窄,镜身可以通过,远端胃,十二指肠未见异常。
强化CT:1、符合胃部分切除术后,吻合口壁增厚伴食管下段扩张;2、胆囊结石:胆总管结合;3、肠淤张;4、前列腺增大;5、动脉硬化。
PET-CT检查:1、胃癌大部切除术后改变;肝左外叶近包膜下高代谢结节(于临近胃食管吻合口分界欠清),考虑肝转移。2、右肺中上叶多发结节伴代谢轻度增高;双肺间质纤维化;双肺泡性气肿;经根部气管憩室;贫血;动脉硬化;双侧胸膜增厚;右肺门及纵隔内多发淋巴结增生。
行CT引导下肺部肿物穿刺活检术,病理回报:(肺穿刺物)结合HE形态及IHC支持为腺癌,结合病史及IHC表型考虑转移可能性大,请结合临床。免疫组化结果:TTF-1(-),HER2(+++)
 △ 2019.7影像学检查
△ 2019.7影像学检查
MDT-3讨论
诊断:胃癌术后,腹腔转移,肺转移
讨论:患者术后3年余,考虑出现复发及转移,肺转移病灶病理提示HER2(+++),请相关科室讨论,指定下一步治疗计划:放疗+靶向治疗+化疗,以控制肿瘤病灶。
2019年9月至2019年10月射波刀治疗。
2019年11月至2020年1月患者合并有贫血,肺炎,予以对症支持治疗。
在此基础上予以靶向治疗及化疗:赫赛汀+奥沙利铂+替吉奥1周期。
患者呕吐、进食差,更改方案为赫赛汀+替吉奥2周期。
2020-01-08复查腹部CT:与患者前片(2019-7-8)比较显示:食管胃吻合口区低密度病变范围较前缩小。所示腹部其余病变较前未见明显变化,双肺片状高密度影,双侧胸腔积液。
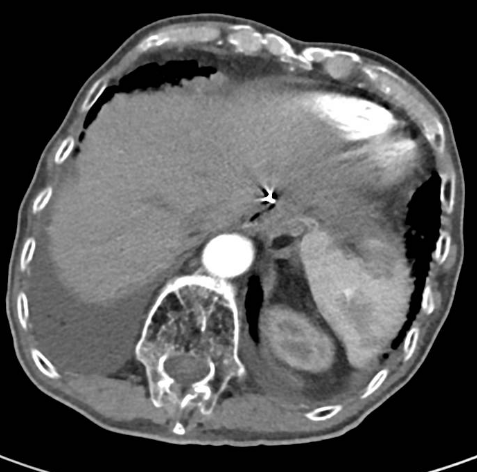
△2020.01腹部CT
2020-01-08查胸部CT:双肺间质纤维化伴双肺气肿,双肺炎症,伴支气管扩张,右肺上叶结节样影,性质待定,双侧胸腔积液,纵膈多发肿大淋巴结,主动脉及冠状动脉硬化。

2020年1月-2020年8月:单药赫赛汀3周期
2020-08-31复查腹部CT:与患者前片(2020-1-8)比较显示:所示腹部病变较前未见明显变化。双肺高密度影范围较前缩小。

△ 腹部CT 2020.08
2020-08-31复查胸部CT:右肺结节影,结合病史考虑转移性病变,左侧局限性气胸,双肺气肿,双肺间质性病变,双侧胸腔积液;心脏增大,主动脉硬化。
目前状态:对症支持的基础上予以间断赫赛汀靶向治疗,目前带瘤生存,ECOG评分:2分;合并贫血,OS 63个月。
?
专家点评
1、本例患者为局部晚期食管胃结合部腺癌,合并出血,贫血、进食困难、低蛋白血症。在这种情况下,为解决出血、进食困难,以改善患者进食,纠正贫血,低蛋白血症行姑息性手术是有指证的。虽然食管胃结合部肿瘤较大,5×4cm,因考虑患者年龄偏大、一般状况较差,为简化手术方式,姑息手术行近端胃次全切除切除是可行的。
2、既往的研究已经证实局部晚期胃癌(LAGC)术后辅助治疗可以改善患者的生存,但是最优的围手术期治疗模式和方案尚无定论。2019年欧洲肿瘤内科学会上发布的RESOLVE研究结果显示,对于LAGC,围手术期SOX化疗较之术后XELOX辅助可提高3年DFS,术后辅助化疗,SOX方案非劣于XELOX方案。因此该患者术后选择SOX辅助治疗是合理的。
3、该患者术后病理:T4bN2Mx(IIIB);HER2(3+)。因不除外肿瘤残留,经过MDT讨论,给予患者SOX+曲妥珠单抗靶向治疗。胃癌靶向治疗方面,HER2通路在晚期胃癌靶向治疗中最先被突破,TOGA研究是第一个使用HER2抑制剂曲妥珠单抗治疗不能手术的局部晚期、复发或转移的HER2阳性胃癌患者的Ⅲ期临床研究。TOGA研究结果显示在IHC2+/FISH阳性或者IHC3+的患者与对照组相比,OS分别为16.0个月和11.8个月(HR为0.65)。曲妥珠单抗联合化疗显著提高了HER2阳性晚期转移性胃癌的治疗缓解率和总体生存率。基于此项研究,曲妥珠单抗成为2019版NCCN指南推荐的用于晚期胃癌的第一个靶向治疗药物。因该患者术后SOX+曲妥珠单抗治疗6周期后,考虑到只是病期较晚,并没有确定的肿瘤残留,故没有进行曲妥珠单抗的维持治疗。
4、胃癌是一种异质性较强的肿瘤,原发灶和转移灶HER2情况不尽相同,因此建议对复发或转移灶再次活检并检测HER2状态。韩国GASTHER1研究结果表明,175例原发灶HER2为阴性的胃癌中,复发或转移灶的HER2阳性率为5.7%,且与转移部位密切相关(肝转移灶和其他转移部位的HER2阳性率分别为17.2%和3.4%,p=0.012)。本例患者复查发现肝转移、肺转移后,再次行肺穿刺物活检,考虑转移性腺癌,HER2(3+)。为后续治疗提供了更多的可靠证据。再次给予曲妥珠单抗联合化疗,取得较好的疗效。
5、MDT讨论贯穿该患者治疗始终,从最初的姑息性手术治疗,到术后SOX+曲妥珠单抗联合治疗,复发转移时,经过MDT,给予射波刀局部治疗和化疗联合曲妥珠单抗的治疗,经过多学科医生的共同努力,最终使患者获得了长达63个月的OS。
6、该患者治疗过程中美中不足的是,由于患者的依从性和经济原因,复发转移后的治疗,并没有完全按照规定周期进行,并且在化疗+曲妥珠单抗治疗有效时,放弃了原方案,改为曲妥珠单抗维持治疗,如果治疗的更加规范,也许患者会获得一个更长的生存和更好的生活质量。
天津医科大学第二医院胃肠外科
医学博士,主治医师
天津市抗癌协会胃癌专业委员会委员
天津医科大学肿瘤医院胃部肿瘤科
副主任医师,肿瘤学博士
日本癌研有明医院访问学者
中国抗癌协会GIST专委会青年委员
天津市抗癌协会胃癌专业委员会秘书
中国微循环学会胃肠肿瘤学组委员
中国抗癌协会GIST专委会,MDT学组组员
从事胃肠肿瘤外科专业20余年。发表胃癌肠癌相关文章近百篇,擅长胃癌、胃肠道间质瘤等各种胃部良恶性肿瘤的诊断、治疗,尤其擅长标准胃癌根治术和扩大胃癌根治术,腹腔镜胃癌根治术。对胃癌,胃肠道间质瘤围手术期治疗,术后辅助治疗,术中腹腔热灌注化疗、胃癌的转化治疗有深入的研究。
?





 京公网安备 11010502033352号
京公网安备 11010502033352号