新型抗肿瘤药物的研发得益于研究者们对肿瘤生物学行为认知的不断刷新。免疫治疗掀起了肿瘤学发展长河的革命,新型药物不断问世,临床方案不断优化,患者福音不断唱响。免疫检查点抑制剂在多种实体瘤中都已有了成功的实践,免疫+靶向、免疫+免疫等联合方案和协同机制也在不断被尝试和探索。
其中,细胞毒性T淋巴细胞抗原4(CTLA-4)单抗联合程序性死亡受体-配体1(PD-L1)单抗的双免疫疗法前期已在非小细胞肺癌、黑色素瘤、结直肠癌、肝癌、胆道系统肿瘤等瘤种研究中显示出曙光。
深刻认识药物机制才能有助于在临床实践中更加安全、高效地应用好药物,才能将优秀药物的价值发挥极致。本文特邀东部战区总医院秦淮医疗区刘秀峰教授为我们解读CTLA-4单抗与PD-L1单抗的协同增效作用机制。
2002年,美国肿瘤生物学家Schreiber教授提出了“肿瘤免疫编辑”理论。利用该理论,我们可以巧妙地解释免疫系统与肿瘤间的微妙关系。免疫编辑描述了肿瘤在免疫系统调控下最终发生免疫逃逸的过程。这是一个动态的过程,由免疫清除、免疫平衡和免疫逃逸三个不同环节组成[1]。免疫检查点在不同环节干预T细胞活性,最终导致免疫逃逸。
大家所熟悉的免疫检查点抑制剂主要靶点包括CTLA-4、程序性死亡受体-1(PD-1)和PD-L1。CTLA-4在淋巴结中下调T细胞激活;而PD-1和PD-L1在肿瘤微环境中抑制T细胞活性[2]。图1显示了抗肿瘤免疫反应的循环过程,每个周期包含了从肿瘤细胞抗原释放到最终杀伤肿瘤细胞的7个主要步骤,而其中激活状态的效应T细胞是全程中最关键的“武器”[3-4]。
 图1 抗肿瘤免疫反应过程
图1 抗肿瘤免疫反应过程
在T细胞激活阶段(图1步骤3),CTLA-4单抗与PD-L1单抗各司其职,其中CTLA-4单抗能够通过解除抑制T细胞活化的信号,从而维持T细胞激活状态。而PD-L1单抗则通过阻断淋巴结中PD-L1与B7-1分子的相互作用,来增强 T细胞启动与活化。
在效应阶段(图1步骤7),CTLA-4单抗解除肿瘤微环境中调节性T细胞(Treg细胞)的免疫抑制,而PD-L1单抗则阻断PD-L1与PD-1的相互作用,重新激活受抑制的T细胞,使“复活”的效应T细胞迅速杀伤肿瘤细胞。下文将分别阐释CTLA-4单抗和PD-L1单抗的角色、机制及关系。
CTLA-4单抗:解除双“T”细胞抑制,持续激活核心“武器”
初始T细胞表面并不表达CTLA-4,而是在T细胞活化后才表达。在T细胞激活阶段,活化后的T细胞表面表达的CTLA-4可与CD28竞争性结合配体 B7分子,从而降低T细胞活化水平,抑制T细胞增殖。如前所述,CTLA-4单抗则通过解除抑制T细胞活化的信号,从而维持T细胞的激活状态[5]。随后,激活状态的T细胞经血管转运至肿瘤微环境。
在效应阶段,Treg细胞高表达CTLA-4,CTLA-4可通过竞争性结合B7分子,使效应性T细胞CD28分子的活化信号难以启动;还可通过分泌和表达一系列分子,导致吲哚胺2,3-双加氧酶(IDO)上调,诱导效应T细胞凋亡并干扰其代谢。如前所述,CTLA-4单抗在此阶段则可通过阻断Treg细胞上CTLA-4与B7分子的结合,从而解除肿瘤微环境中Treg细胞的免疫抑制,增强效应T细胞活性[6]。
PD-L1单抗:双重阻断PD-1与B7-1,优效减毒多元获益
在免疫细胞长期效应中,肿瘤细胞的PD-L1与T细胞表面B7-1分子的结合会导致T细胞进入“疲惫”状态,使T细胞功能逐渐衰退[7-8]。而PD-L1单抗则可通过阻断肿瘤细胞的PD-L1与T细胞表面B7-1的结合,帮助T细胞长久维持抗肿瘤活性[9-10]。
同时,PD-L1单抗并不阻断与程序性死亡受体-配体2(PD-L2)的结合,不影响PD-L2与PD-1相互作用,由此可减少正常组织中的自身免疫反应,维持机体免疫自稳状态,降低免疫相关不良事件(irAEs)发生风险。但PD-1单抗会同时阻断PD-L2与PD-1的结合,导致平衡向与排斥性导向分子B(RGMB)结合偏移,使大量PD-L2与其第二受体RGMB结合,导致肺驻留T细胞扩增,增加自身免疫性肺炎发生风险[11-12]。
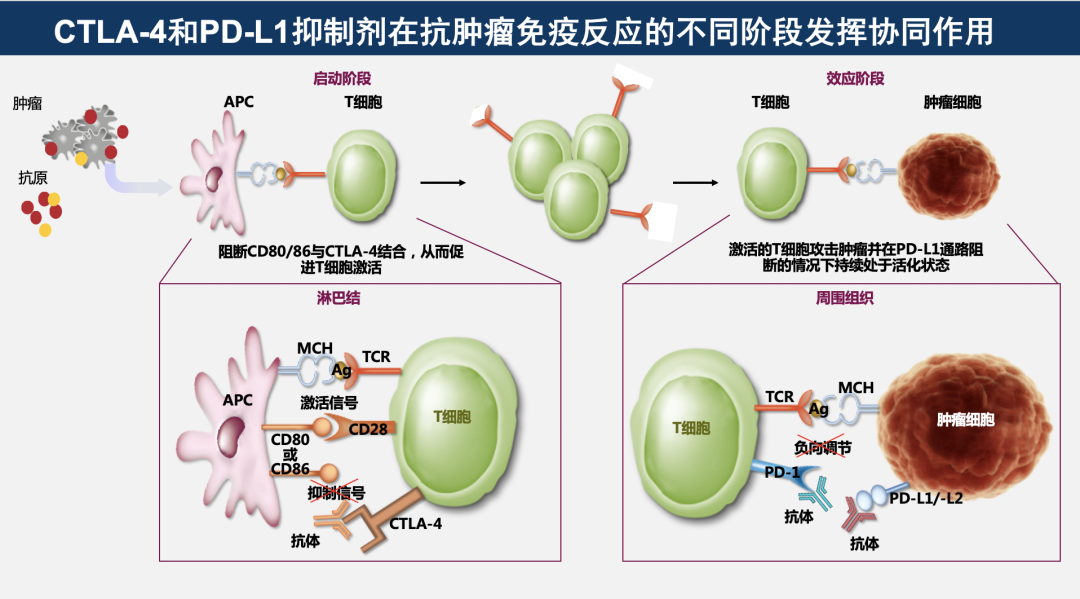 图3 CTLA-4单抗与PD-L1单抗协同抗瘤
图3 CTLA-4单抗与PD-L1单抗协同抗瘤
综上,在T细胞激活阶段,CTLA-4单抗+PD-L1单抗协同发挥“点火”、启动发动机的作用,促使效应T细胞持续快速激活、大量增殖,转运至肿瘤微环境中。而在效应阶段,CTLA-4单抗+PD-L1单抗协同解除了肿瘤细胞的免疫“刹车”作用,使高度活化、“满血复活”的T细胞迅速杀伤肿瘤细胞。
CTLA-4单抗与PD-L1单抗两者的关系,可类比为抗肿瘤战争中“政委”与“司令”的关系——CTLA-4单抗为“政委”,动员更多能抗肿瘤的“仁人志士”(激活T细胞)投入前线;PD-L1单抗则为“司令”,指挥前线“战士”(效应T细胞)奋勇杀敌。“政委”与“司令”的联合必然增加了战役的成功率。同时,PD-L1单抗可维持正常组织中的免疫稳态,减少正常组织自身免疫反应,降低irAEs发生风险。
回归到临床,CTLA-4单抗和PD-L1单抗的协同机制无疑为临床上的双免疫联合用药提供了有力的基础依据。两者联合并非简单的“1+1”,理论上两种药物可相互配合协调,强有力地削弱肿瘤免疫逃逸,促进免疫系统杀伤肿瘤细胞。目前双免疫疗法已在非小细胞肺癌、黑色素瘤、结直肠癌、肝癌、胆道系统肿瘤等多种实体瘤研究中印证了良好疗效。期待这样的优秀组合方案能够早日广泛落地临床实践,早日使更多患者更大获益!
东部战区总医院秦淮医疗区肿瘤内科 副主任/主任医师
CSCO 理事/副秘书长
CSCO 肝癌专家委员会秘书长
CSCO 胆道肿瘤专家委员会副主任委员
CSCO 胰腺癌专家委员会委员
[1] Vesely ,et al, Ann Rev Immunol 2011, 29: 235.[2] Boutros C, et al. Nat Rev Clin Oncol. 2016;13:473-486.[3] Immunity. 2013;39:1-10.[4] Eur J Cancer. 2016 Feb;54:139-48.[5] Vasaturo A, et al. Front Immunol. 2013;4:417.[6] Annu Rev Immunol. 2016 May 20;34:539-73.[7] Shannon M. Kahan,etal.,Viruses. 2019 Feb; 11(2): 156.[8] Day CL,et al.Nature. 2006 Sep 21;443(7109):350-4.[9] Butte MJ,et al.Immunity. 2007 Jul;27(1):111-22.[10] BoussiotisVA. et al. N Engl J Med 2016;375:1767-78.[11] Chen DS, et al. Clin Cancer Res. 2012 Dec 15;18(24):6580-7.[12] Tabchi S,etal.,Curr Opin Oncol.2016 Jul;28(4):269-77.审批编号:CN-65138,有效期至2022-9-21





 京公网安备 11010502033352号
京公网安备 11010502033352号